专访智核®生物丨国内放射性诊断药物首获中美双IND批准,三大技术平台协助构建低毒、高效的创新核药
原创#生辉
由于放射性元素对于人体强烈的毒副作用,一直以来,人们对于核医学总是望而生畏。
核医学是将放射性核素示踪技术应用于医学领域的一门子学科,其能够实现无创、精准、靶向性的诊断和治疗作用。该领域中主要包括了核医学设备和放射性药物(核药),后者一般指含放射性核素的,用于临床诊断或治疗的化学、生物制剂及其他核素标记药物制剂。
长期以来,由于原料供应、相关法规以及人才资源等方面的制约,我国放射性药物的研发及产业化进程十分缓慢。然而,随着靶向、连接技术、核素生产控制等技术的发展和成熟,伴随核药的毒害作用得以改善,治疗效果则向上突破,以体内核药诊疗为基础的“诊疗一体化”形成趋势。鉴于其在临床上的巨大潜力,核药市场的未来不言而喻。
日前,由国内创新核药的先行者——苏州智核®生物(以下简称“智核®生物”)自主研发的重组人促甲状腺素注射液(SNA001)的生物制品许可申请(BLA)已获得 CDE 受理。据悉,该药物拟用于“无远处转移分化型甲状腺癌患者在甲状腺全切或近全切术后碘[131I]清除残余甲状腺组织的治疗”。该进展有望使其成为国内首个上市的重组人促甲状腺素(rhTSH),或将打破该类药物在国内二十余年的空白状态。
除此之外,该公司旗下 68Ga 标记 PD-L1 的放射性显影诊断药物 SNA002 也已获得 CDE 和 FDA 双方的临床试验申请批准。“基于具有自主知识产权的单域抗体放射性药物发现、研发、生产技术平台,当前研发管线已涵盖 10 多个创新核素诊断和治疗产品。”智核®生物创始人须涛博士表示,“智核®生物将始终专注于研发自主创新、真正满足临床需求的放射性诊疗药物。”

据悉,智核®生物成立于 2015 年,该公司旨在为全球患者提供创新性的放射性核素诊疗药物。目前,其产品覆盖甲状腺癌、肺癌、乳腺癌、肿瘤放射性核素诊断药物与治疗药物等领域。公司成立至今已获得 4 轮累计超过 2 亿元的风险投资。
首发管线重组人促甲状腺素(rhTSH)有望于明年上市
2021 年 2 月至今,CDE 相继发布了《放射性体内诊断药物非临床研究技术指导原则》与《放射性体内治疗药物临床评价技术指导原则》,标志着我国放射性药物的研发及产业化进入了快速发展的篇章。
放射性药物(radio pharmaceutical,也称为核药)是指含有放射性同位素的一类特殊药物,该类药物在机体内能够实现医学诊断或治疗的功效。其中,诊断性核药在进入人体后,使用核医学设备如 PET-CT,可检测到药物发出的辐射射线,从而确定人体内疾病的位置和状态;而治疗性药物则可用于治疗部分癌症、转移性骨痛等疾病。
可以说,放射性药物连同核医学分子影像技术,在疾病特别是肿瘤的筛查、诊断、疗效监测以及个性化治疗等多个方面,均发挥着不可替代的作用,已经成为了精准医学的重要组成部分。
在踏入核药领域的大门之前,须涛已经潜心在生物制药领域中实践多年。基于其在重组蛋白与单域抗体领域的深厚经验,结合国内核药市场的巨大空白,他于 2015 年率先启动了 rhTSH(SNA001)的研发工作,并以此为基础创立了智核®生物。
促甲状腺激素(TSH)是糖蛋白激素家族成员,其能够增加碘以及放射碘的摄取和有机化,从而杀伤甲状腺癌细胞。与此同时,TSH 的激活也可以导致甲状腺细胞释放甲状腺球蛋白(Tg)、三碘甲状腺原氨酸(T3)和甲状腺素(T4),其中 Tg 作为血液中甲状腺癌的肿瘤标志物,被用于检测甲状腺癌。
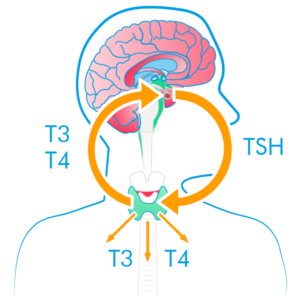
重组人促甲状腺素(rhTSH)是基于生物技术生产的化合物,其在分子结构及作用方面与天然促甲状腺激素(TSH)相同。
目前,国际公认的分化型甲状腺癌治疗金标准为“甲状腺切除手术+放射性碘治疗+促甲状腺激素替代抑制治疗+长期随访”。在放射性碘治疗前,使用 rhTSH 可安全、快速提升人体血清促甲状腺素水平,避免因停服甲状腺激素产生的不良反应,因此获得诸多国内外相关临床指南一致推荐:采用 rhTSH 作为碘 131 治疗前与随访复查检测中停服甲状腺激素时的替代疗法。
在 2021 年和 2014 年,国内先后发布的两版甲状腺癌诊疗指南并将 rhTSH 写入其中,但尚未有相关药物获批。纵观国际市场,美国 Sanofi 公司的 rhTSH 药物 Thyrogen 早在 1998 年已经获批并进入市场。另根据 Frost & Sullivan 的预测,由于国内甲状腺癌患者数量的逐年增加,相关 rhTSH 市场将由 2023 年的 1.6 亿元增长到 2030 年的 14.1 亿元。
“考虑到 SNA001 在临床上的巨大市场需求,智核®以其作为首发管线,在填补市场空白的同时公司团队经历从零到 BLA 的完整流程,这将有助于后续创新管线的快速推进。”须涛表示,目前 SNA001 的上市申请已获得 CDE 正式受理,最快有望于明年获批上市。
三大技术平台协助构建低毒性、高穿透性和高特异性的创新核药
除治疗性核药之外,诊断性核药成为了智核生物的另一个重点发展方向须涛介绍道,“使用放射性诊断药物,能够实现无创、实时、动态显像全身靶向抗原的表达水平,从而能及时发现转移病灶,获取各个病灶在不同空间、不同时间的抗原的表达水平。”
智核®生物专有的单域抗体同位素偶联药物(Single-domain antibody Radionuclide Conjugates,简称 SRC)平台为基础,其自主研发的 68 Ga 标记 PD-L1 放射性显影诊断药物 SNA002 已获得 CDE 临床试验默认许可。另一方面,该药物于今年 4 月获得美国食品药品监督管理局(FDA)IND 批准,这意味着 SNA002 成为国内首个获得中美 IND 双批准的放射性核素显影药物。
据悉,SNA002 是以单域抗体为前体,偶联 PD-L1 靶点的放射性显影药物,拟用于评估实体瘤患者原发和/或转移病灶 PD-L1 表达水平。
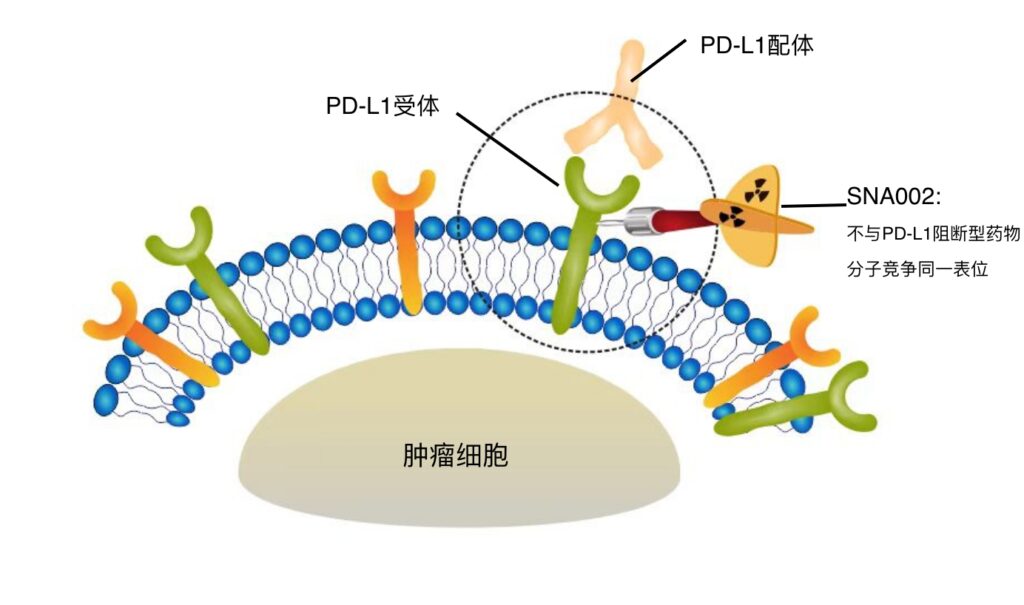
该药物在注射 1-2 小时后,即可通过 PET-CT 的方式进行显影,实时、动态显示全身各脏器 PD-L1 的表达水平,包括肿瘤内部和微小转移灶的异质表达。
现如今,PD-L1 单抗已经成为全球性的抗癌产品。据 Frost&Sullivan 数据显示,到 2023 年,全球 PD-L1 抑制剂市场将达 639 亿美元,国内市场规模同样高达 664 亿元人民币。
值得注意的是, PD-L1 的表达具有时空异质性和个体特异性。因此,基于临床端的迫切需要,用于评估体内 PD-L1 表达水平的非侵入性检测技术应运而生。该类技术和药品对于指导肿瘤患者精准用药、节约医疗费用具有重大的实际应用价值。
“从应用角度来看,其对于准确筛选治疗人群、优化治疗模式、治疗剂量和周期,以及评价后期疗效等方面具有良好的指导意义。”须涛介绍道,而从技术角度来看,该药物基于单域抗体螯合放射性同位素的设计,通过抗体与人体中对应抗原的结合靶向到肿瘤特定部位,并以螯合的同位素发挥诊断或治疗功效。
简单来说,放射性药物的分子结构类似于 ADC(抗体药物偶联物)药物,主要以前体、linker(连接臂)和同位素组成。而智核生物创新性地设计并使用单域抗体作为前体,其较小的分子量带来更强的肿瘤穿透能力——普通抗体需经过 2-3 天才能聚集到肿瘤部位,而单域抗体仅 1-2 个小时就可以进入肿瘤内部,完成全身目标抗原的检测。另一方面,该设计兼具抗体前体便于筛选高亲和力分子的优势,为药物带来更高的特异性。
不过,过高的毒副作用始终是放射性药物治疗无法回避的难题,也是研发企业所面对的重大挑战。对此,>智核生物开发了独具特色的 SmartSDBC(表面定点偶联),SmartPaa(预存抗体抵抗技术)和 SmartRel(肾脏刷状缘可酶切连接子)三大技术平台。其中,SmartRel 技术能够在药物进入肾脏时将同位素切下,使其进入膀胱代谢,将大大降低其对于肾脏的毒性和负担。
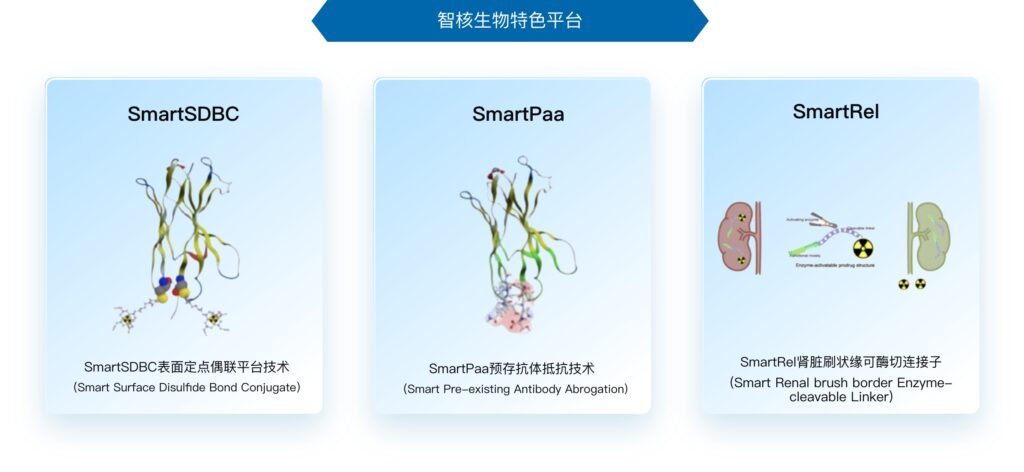
“基于智核®生物的平台技术,我们将有机会针对于更多已上市的抗体药物或者成熟靶点开展研发工作,”须涛介绍道,例如当前智核生物旗下靶向 CD8 的放射显影剂产品已经进入 IND 申报进程。
“核药研发始终以安全性为第一出发点。使用小分子量的单域抗体,在提高肿瘤穿透性的同时,其在血液中的滞留时间大大减少,能够以快进快出的方式发挥作用,这将有助于保证患者的安全。在此基础之上,再考虑有效性的问题。”
当前的核药物治疗市场依然是一个高度整合的市场,目前由诺华制药所主导。据悉,诺华于 2019 年就占据了百分之四十二的市场份额,除此之外,连同拜耳和中国同辐(China Isotope&Radiation)在内,上述企业共占据全球治疗核能总估值百分之八十四以上的药品市场。
“核素药物的生产大都存在放射性风险,对于企业的技术、资质和审核要求均十分严格,这就需要完善的行业法规起到引领和监督作用。”须涛对此谈道,“过去,国内核药生产企业主要依赖于进口原料,这成为了国产放射性药物制备及核医学发展的行业瓶颈。”
而近年以来,CDE 连续出台关于放射性体内诊断药物、放射性体内治疗药物的相关规范与技术指导原则,正在为核药领域带来引领作用。相关体系的完善在促进上游原料企业发展的同时,也带动了下游产品和药物生产企业的快速推进。须涛同时表示,作为一个创新领域,尽管当前的核医学仍存在产业配套落后、人才储备不足等问题,但随着该领域的发展,这些问题将会迎刃而解。
1.https://www.smartnucl.com/archives/technology/platform
